Bristol-Myers Squibb Company a obtenu 18 autorisations pour de nouveaux médicaments et des indications et formulations supplémentaires en 2022.
Ces médicaments sont actuellement commercialisés sur les principaux marchés de l’entreprise, à savoir les États-Unis et le Japon.
Avec 34 300 employés dans 44 pays, Bristol-Myers Squibb est une société biopharmaceutique mondiale dont la mission est de découvrir, développer et fournir des médicaments innovants qui aident les patients à surmonter des maladies graves.
Parmi ses avancées en oncologie, la Food and Drug Administration (FDA) américaine et la Commission européenne (CE) ont approuvé Opdualag, la première combinaison d’un inhibiteur de PD-1 et d’un anticorps bloqueur de LAG-3.
En outre, aux États-Unis, la FDA et la CE ont approuvé le premier inhibiteur de PD-1 et anticorps bloqueur de LAG-3.
Les États-Unis, l’Union européenne et le Japon ont approuvé deux schémas thérapeutiques à base d’Opdivo en tant que traitements de première ligne pour le cancer ESCC métastatique avancé ou non résécable.
La société continue de progresser et d’investir dans son portefeuille de thérapies cellulaires avec l’approbation d’Abecma au Japon pour le traitement du myélome multiple chez les patients ayant reçu au moins trois traitements antérieurs, et les approbations de Breyanzi pour le lymphome diffus à grandes cellules B récidivant ou réfractaire, avec des traitements de deuxième ligne aux États-Unis et au Japon, et de troisième ligne dans l’UE.
Bristol-Myers Squibb continue également à développer ses capacités de fabrication de thérapies cellulaires dans ses installations existantes de Washington et du New Jersey, ainsi que par la construction de nouvelles installations de fabrication de pointe dans le Massachusetts et à Leiden, aux Pays-Bas.
Nouveaux médicaments
Les autorisations de Sotyktu (deucravacitinib) aux États-Unis et au Japon pour le traitement du psoriasis en plaques modéré à sévère ont élargi son portefeuille en immunologie.
Dans le domaine cardiovasculaire, la société a élargi son pipeline de nouveaux produits avec l’approbation par la FDA de Camzyos (mavacamten) pour les patients atteints de HCM obstructive symptomatique.
En outre, en août 2022, elle a acquis Turning Point, une société d’oncologie de précision, pour élargir son portefeuille de tumeurs solides avec l’ajout du repotrectinib.
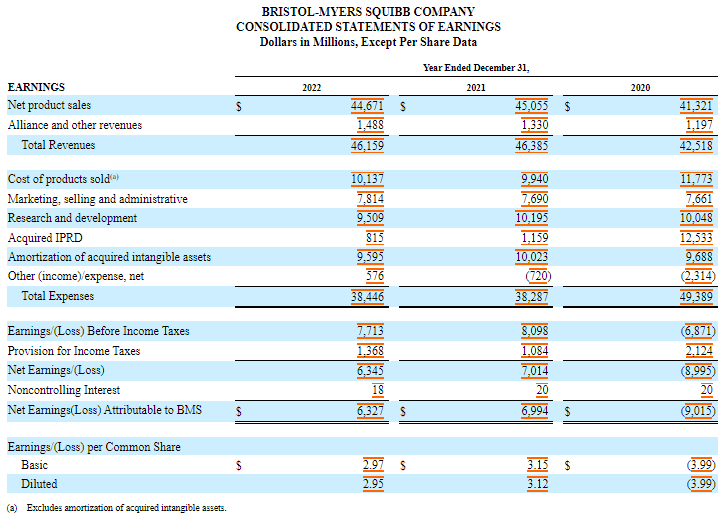
Ses dépenses en R&D se sont élevées à 9,5 milliards de dollars en 2022, 10,2 milliards de dollars en 2021 et 10 milliards de dollars en 2020.
Les dépenses de recherche et développement en cours (IPRD) acquises se sont élevées à 815 millions de dollars, 1,2 milliard de dollars et 12,5 milliards de dollars en 2022, 2021 et 2020, respectivement.
En 2020, les IPRD acquises comprenaient une charge de 11,4 milliards de dollars résultant de l’acquisition de MyoKardia.
![]()

